
從 19 世紀末開始,科學家們就從各種生物體(例如人類、小鼠、豬、雞和植物)中分離出自然環境中的細胞,并將它們置于體外(拉丁語“玻璃中")中。 ) 文化。實驗細胞是從許多不同的組織和器官中提取的,例如腸、腎、血液、腦、乳腺和許多癌癥實體。
體外培養細胞的目的是模擬培養箱內的體內(拉丁語“活體中")條件,或者在進行活細胞成像時甚至在顯微鏡下模擬體內條件。每種細胞類型都需要定制培養參數,以實現最佳的健康、活力和生長。對于所有實驗,保持條件無菌、均質和可重復至關重要,以獲得可比較的結果。
為了保持細胞處于增殖狀態,并防止它們達到過度匯合,以規定的時間間隔進行傳代非常重要。必須定期進行細胞傳代,以保持細胞處于培養狀態、實現體積放大或在實驗開始時接種它們。該過程也稱為細胞分裂或傳代培養。除其他因素外,傳代的最佳時間取決于增殖率以及所需的細胞數量。每種細胞類型的確切裂解方案都是b的。一般來說,貼壁細胞使用蛋白水解酶(主要是胰蛋白酶/EDTA)從基質上分離,這對于消化其蛋白質附著鍵是必需的。接下來,將細胞勻漿、計數并接種到新容器中,從而將傳代次數增加一倍。
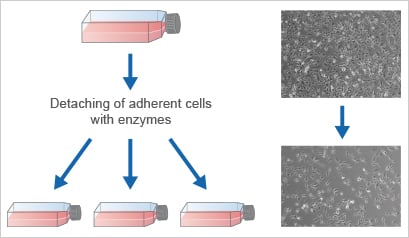
傳代/傳代=將細胞轉移到新鮮的培養皿和生長培養基中
一些細胞系,例如 HeLa 或其他缺乏細胞周期調節的癌細胞,可以無限傳代而不喪失分裂能力(永生細胞系)。此外,某些胚胎細胞類型或多能干細胞也是如此。其他細胞,特別是原代細胞(例如,從成體器官中分離的細胞),在幾次傳代后將失去這種能力,因為它們要么經歷衰老,要么分化,要么死亡。因此,使用具有相似傳代數的細胞進行可重復的實驗非常重要。
對于細胞接種,需要選擇適合各自細胞類型、細胞培養容器和實驗裝置的密度。如果密度太低,細胞可能會由于生長因子釋放到培養基中不足而停止生長。缺乏細胞間和細胞間基質通訊的單個細胞甚至可能因一種特殊形式的程序性細胞死亡(稱為失巢凋亡)而死亡。如果接種密度太高,細胞可能在很短的時間內就已經達到過度匯合。這會導致增殖受損和細胞與基質分離,從而導致實驗條件不可重復。
標準細胞類型可在 –80°C 下短期保存,或在液氮中長期保存。為此,需要對細胞進行胰蛋白酶化、均質化和離心,然后使用特殊的冷凍介質進行冷凍。為了對抗此過程引起的細胞應激,建議使用具有高回收率的冷凍介質。此外,解凍過程必須快速進行(例如,在37°C的水浴中),然后將細胞轉移到培養基中并將其放入培養箱中以創造生理條件。
hihi用u